Humanmedizin oder Tiermedizin – wer hat „Anspruch“ auf welche Antibiotikaklasse. Immer wieder wird diskutiert, dass man bestimmte Wirkstoffe als „Reserveantibiotika“ den Menschen vorbehalten müsse. Jetzt hat die Weltgesundheitsorganisation (WHO) eine Liste vorgelegt, in der sie erstmals ausdrücklich solche „Reserveantibiotika“ definiert. Welche Folgen hat das für die Tiermedizin?
von Annegret Wagner und Jörg Held
Der Begriff „Reserveantibiotika“ bestimmt schon länger die politische Debatte in Deutschland – ohne dass einer der Akteure bisher eine präzise Wirkstoffliste geliefert hätte. Der Wissenschaftliche Dienst des Bundestages hat es hier versucht.
International hat sich die Bezeichnung „Critical Important Antimicrobials“ (CIA) etabliert. Innerhalb dieser Gruppe wiederum werden einige Wirkstoffe als „Highest Priority Critically Important Antimicrobials“ (HPCIA) bezeichnet. In Deutschland und der EU zählt man dazu Fluorchinolone und Cephalosporine der 3./4. Generation. Um die Zuordnung von Makroliden und Colistin wird noch gerungen.

WHO-Neubewertung: Drei Antibiotika-Kategorien
Hier könnte die Weltgesundheitsorganisation (WHO) jetzt neue Weichen stellen. Sie legt für die Humanmedizin(!) eine neue Kategorisierung der Antibiotika vor – und definiert dabei erstmals auch namentlich echte „Reserveantibiotika“ (siehe Tabelle „Reserve“ unten):
- „Access“ („Einstieg“)
- „Watch“ („Überwachung“ – entspricht weitestgehend der bisherigen CIA/HPCIA-Einstufung)
- „Reserve“
Es ist ist die umfangreichste Neubewertung seit 40 Jahren. Im Originaldokument hat die WHO für eine Vielzahl von Antibiotika zusätzlich Indikationen für den ersten/zweite-Wahl-Einsatz aufgelistet (PDF-Download* hier). Dabei fokussiert sie auf die 39 wichtigsten Wirkstoffe zur Behandlung der 21 häufigsten Infektionen. Die Empfehlungen sollen ausgebaut werden, wenn sie sich als hilfreich erweisen.
Erste Wahl: Die „Access“-Kategorie
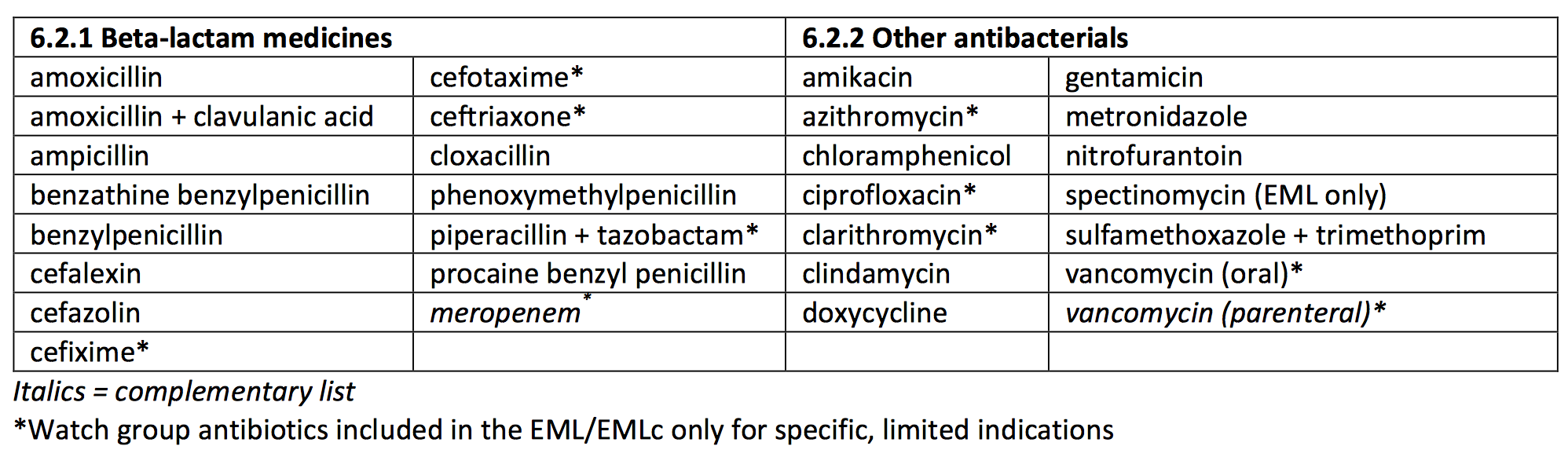
Die Wirkstoffe der „Einstiegs“-Kategorie sollten nach WHO-Auffassung jederzeit verfügbar sein und eine breite Palette gängiger Infektionen abdecken. Sie gelten als Mittel der ersten und zweiten Wahl. Hierzu zählt etwa Amoxicillin, das bei vielen Infektionen (z.B. Lungenentzündungen) eine gute Wirksamkeit hat (alle Wirkstoffe siehe Tabelle).
Die Tabelle listet auch einige Wirkstoffe aus der nächst höheren „Watch-Group“ auf. Die sind aber nur für einige wenige bestimmte Indikationen als erste Wahl gestattet.
Überwachen und dokumentieren: Die „Watch“-Group
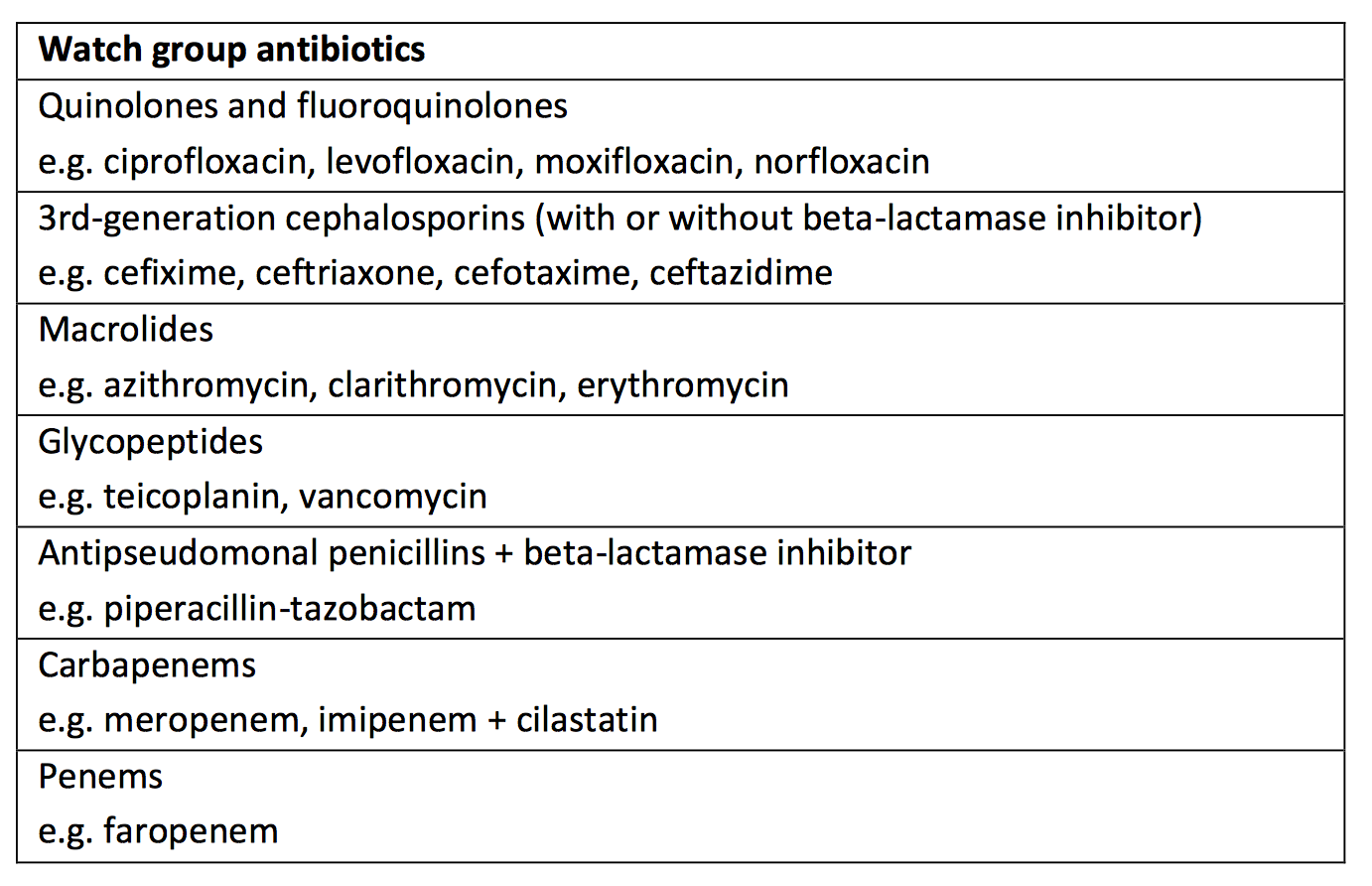
Für die Antibiotika in der „Überwachungsgruppe“ sieht die WHO eine hohes Resistenzbildungsrisiko. Deren Einsatz als Mittel der ersten oder zweiten Wahl akzeptiert sie deshalb nur für wenige, sehr spezielle Indikationen – so etwa für Ciprofloxacin bei Blasenentzündungen (mehr hier – PDF-Download).
„Überwachung“ haben die WHO-Experten diese Kategorie deshalb genannt, weil sie es für notwendig halten, die Anwendung dieser Wirkstoffe zu reglementieren, zu dokumentieren und zu überwachen, um Missbrauch zu minimieren. Das soll den Einsatz dieser Wirkstoffe deutlich reduzieren.
Die „Watch“-Group umfasst die meisten Präparate, die bislang als „Highest Priority“-Substanzen der Klasse der „Critically Important Antimicrobials“ eingestuft waren. Aus tiermedizinischer Sicht sind das zum Beispiel die Fluorchinolone, die Cephalosporine der 3. Generation und die Makrolide. Aber auch Wirkstoffe wie die Carbapeneme, die in deutschen Medienberichten bisher oft als „Reserveantibiotika“ genannt und für die Tiermedizin gar nicht zugelassen sind, finden sich hier.
Erste offizielle „Reserveantibiotika-Liste“
Erstmals benennt die WHO jetzt auch offiziell eine Gruppe von „Reserve“-Wirkstoffen. Die sollen in der Humanmedizin als Mittel der letzten Wahl (“last resort options“) eingesetzt werden – bei ernsthaften und lebensbedrohenden Krankheiten, wenn andere Antibiotika sich als unwirksam erwiesen haben (MRSA, ESBL). Ihre sehr restriktive Anwendung sollte in jedem Fall begründet und auch überwacht werden. Die WHO erwartet, dass die nationalen Gesundheitsbehörden sie „schützen“ – mit nationalen und internationalen Monitoringprogrammen. So will man die Wirksamkeit dieser Substanzen so lange wie möglich erhalten.

Erste offizielle Liste der WHO mit expliziten „Reserveantibiotika“ der Humanmedizin. (Tabelle: © WHO)
Konsequenzen der WHO-Liste für die Tiermedizin
Ob und welche Konsequenzen die neue WHO-Liste für die Tiermedizin hat, ist noch offen. Es dürfte aber fast sicher sein, dass die hier jetzt auch offiziell als für die Humanmedizin äußerst wichtig definierten „Reserveantibiotika“ für die Tiermedizin künftig noch strenger reguliert werden. Das trifft Cephalosporine der 4. Generation und Colistin. Die anderen Wirkstoffe sind nicht für Tiere zugelassen.
Auswirkungen für 4.-G-Cephalosporine und Colistin
Mit Cefoquinom ist in der Veterinärmedizin aktuell nur ein Cephalosporin der 4. Generation im Handel. Es wird vor allem bei Milchkühen als Mastitispräparat regelmäßig und mit gutem Erfolg eingesetzt. Mengenmäßig dürfte es vermutlich fast die Hälfte der in der Tiermedizin eingesetzten Cephalosporine ausmachen. Milchkühe – und damit der Einsatz dieses Wirkstoffes – werden bisher aber (noch) nicht vom staatlichen Antibiotikamonitoring erfasst.
Der zweite, in der Tiermedizin relevante Wirkstoff aus der Reserve-Kategorie ist Colistin. Dieses Medikament ist aufgrund seiner guten Wirksamkeit gegen spezielle Infektionserreger trotz schlechter Verträglichkeit im Humansektor zur absoluten „Reserve“ aufgestiegen – und wird von Humanmedizinern inzwischen auch exklusiv für Menschen reklamiert.
Für Tiere wiederum ist es gut verträglich und wirkt unmittelbar im Darm sehr gut bei Infektionen. Auch ist die Resistenzlage in der Tiermedizin gut. Colistin gilt vielen Tiermedizinern daher als unverzichtbar – auch weil man ansonsten auf andere, bisher als kritischer eingestufte Wirkstoffe (etwa Fluorchinolone) ausweichen müsste. Die in Deutschland und der EU bereits laufende Debatte über Colistin in der Tiermedizin dürfte durch die WHO-Einstufung neu angeheizt werden.
Ansonsten folgt die neue WHO-Einstufung zwar im Großen und Ganzen der alten Klassifizierung, doch hat es auch einige Neubeurteilungen gegeben.
Die Beta-lactam-Antibiotika befinden sich weitgehend in der „Einstiegs“-Gruppe. Lediglich die Cephalosporine wurden noch weiter unterteilt:
Die der ersten und zweiten Generation befinden sich in der 1. Access-Kategorie, die Cephalosporine der dritten Generation in der 2. Gruppe „Überwachung“ und die Cephalosporine der vierten und fünften Generation gehören zur 3. „Reserve“-Gruppe.
Warum eine Neueinteilung?
Die WHO erkennt weiter einen deutlich zu hohen und teilweise nicht sachgerechten Einsatz von Antibiotika in Human- und Tiermedizin. Dies belegen für Deutschland auch neue Auswertungen aus der Humanmedizin (mehr hier).
Dr. Suzanne Hill, WHO-Direktorin des Gebiets „Essential Medicine and Health Products“, spricht darüber hinaus sogar von Missbrauch. Alles zusammen begünstige den Anstieg von Antibiotikaresistenzen. Die neue und sehr ausführliche Antibiotikaliste (PDF-Download hier) soll den Staaten und (Tier)Medizinern helfen, die jeweils richtigen Präparate auszuwählen. Menschen, die Antibiotika benötigen, sollen diese auch bekommen – aber möglichst nur die jeweils passenden Wirkstoffe, damit sich die Resistenzsituation nicht noch weiter verschlechtert.
Konsequenzen einer Regulierung
Die zu erwartende und auch gewollte strengere Überwachung und Regulierung gut wirksamer Antibiotika birgt – das erkennt die WHO durchaus an – auch Risiken. Sie fördere nicht unbedingt die Bereitschaft der Pharmaindustrie, neue antibiotisch wirksame Substanzen zu entwickeln. Investition in die Forschung würde sich unter Umständen nicht lohnen. „Wir müssen eine Lösung finden, wie wir die Unternehmen dafür bezahlen, dass sie ihre Produkte nicht vermarkten, sondern als Reserve zurück halten. Das wird eine echte Herausforderung“, erklärte Dr. Hill.
Auch Deutschlands Gesundsheitsminister Hermann Gröhe machte aktuell deutlich, dass die Politik Wege finden müsse, um die Hersteller zu motivieren, neue Wirkstoffe zu entwickeln. Gesucht seien Vergütungsmodelle, bei denen der wirtschaftliche Erfolg eines Präparats nicht alleine vom Umsatz abhänge.
Bisher hat sich die Politik aber nur zur Förderung neuer Wirkstoffe positioniert. Wie man aber mit in der Tiermedizin zugelassenen Medikamenten umgeht, wenn die zugrundeliegenden Wirkstoffe tatsächlich als „Reserve“ allein der Humanmedizin zugestanden würden (Stichwort: Cefoquinom), dazu hat sich noch niemand geäußert.







 „Wildtiere brauchen in den aller seltensten Fällen menschliche Hilfe," sagt die Landestierschutzbeauftragte Hessen. Was tun kann, wer ein Wildtier findet – oder aber auch besser lassen sollte – erklärt ein Flyer, den Dr. Madeleine Martin zusammen mit der Landestierärztekammer Hessen herausgegeben hat.
„Wildtiere brauchen in den aller seltensten Fällen menschliche Hilfe," sagt die Landestierschutzbeauftragte Hessen. Was tun kann, wer ein Wildtier findet – oder aber auch besser lassen sollte – erklärt ein Flyer, den Dr. Madeleine Martin zusammen mit der Landestierärztekammer Hessen herausgegeben hat.