Erstmals empfiehlt die Europäische Arzneimittelagentur (EMA) die Zulassung eines stammzellbasierten Präparats für Tiere. Dies sei ein Meilenstein für neue Behandlungsstrategien in der Tiermedizin.
(PM/BVL) – Es sei ein Meilenstein in der Tiermedizin, schreibt das für Arzneinittelzulassungen zuständige Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL): Erstmals wurde vom Ausschuss für Tierarzneimittel (CVMP) der Europäischen Arzneimittelagentur (EMA) die Zulassung eines stammzellbasierten Präparates empfohlen. Das Produkt Arti-Cell Forte soll bei Pferden zur Behandlung von leichten bis moderaten Lahmheiten aufgrund von Gelenkentzündungen eingesetzt werden. Es wäre das erste zugelassene stammzellbasierte Tierarzneimittel innerhalb der Europäischen Union.
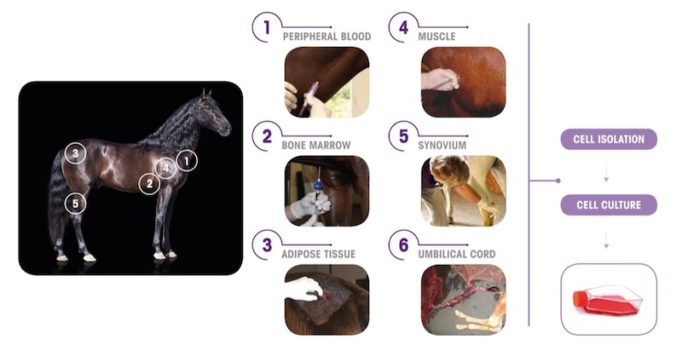
Stammzellen aus Pferdeblut
Enthalten ist ein Stammzelltyp, der aus Pferdeblut gewonnen wird. Das fertige Präparat wird als Suspension einmalig in das betroffene Gelenk injiziert. Stammzellen haben die Fähigkeit, sich in unterschiedliche Zelltypen differenzieren zu können.
Die in Arti-Cell Forte eingesetzten Stammzellen sind so behandelt, dass sie sich zu Knorpelzellen entwickeln können und darauf abzielen, knorpelschützende Mechanismen zu aktivieren. Eine Feldstudie bei Pferden mit Lahmheit im Fesselgelenk zeigte eine signifikante Verbesserung der behandelten Tiere im Vergleich zur Placebo-Kontrollgruppe.
Die häufigsten Nebenwirkungen waren ein leichter Anstieg der Lahmheit und Reaktionen an der Injektionsstelle in der ersten Woche nach der Behandlung.
„Wichtig für neue Behandlungsstrategien der Tiermedizin“
Die Empfehlung des zur europaweiten Zulassung dieses Arzneimittels sei ein wichtiger und innovativer Schritt und liefere Potenzial für neue Behandlungsstrategien in der Tiermedizin, kommentiert das BVL.







 „Wildtiere brauchen in den aller seltensten Fällen menschliche Hilfe," sagt die Landestierschutzbeauftragte Hessen. Was tun kann, wer ein Wildtier findet – oder aber auch besser lassen sollte – erklärt ein Flyer, den Dr. Madeleine Martin zusammen mit der Landestierärztekammer Hessen herausgegeben hat.
„Wildtiere brauchen in den aller seltensten Fällen menschliche Hilfe," sagt die Landestierschutzbeauftragte Hessen. Was tun kann, wer ein Wildtier findet – oder aber auch besser lassen sollte – erklärt ein Flyer, den Dr. Madeleine Martin zusammen mit der Landestierärztekammer Hessen herausgegeben hat.