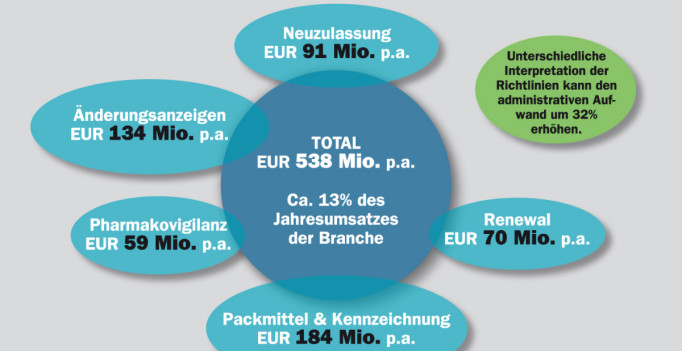
538 Millionen Euro und damit rund 13 Prozent des Jahresumsatzes müsse sie für bürokratische Aufwand rund um Medikamentenzulassungen ausgeben, beklagt die europäische Tierarzneimittelindustrie. Das Problem ist sowohl in Europa als auch den USA erkannt. Die zuständigen Behörden wollen deshalb die Zulassung neuer Tiermedikamente erleichtern.
Vereinfachte Verfahren und damit verbundene Kosteneinsparungen sollen die Bereitschaft der Pharmaindustrie zur Entwicklung neuer Medikamente verbessern. Die Hoffnung: So werde es künftig mehr „zugelassene“ Medikamente für Tiere mit geringer wirtschaftlicher Bedeutung geben. Umstrittene Umwidmungen (extra label use) und die damit verbundenen Unsicherheiten im Bezug auf Dosierungen und Wartezeiten könnten so überflüssig werden.
USA will „doppeltes Verfahren“ abschaffen
Die amerikanische Gesundheitsbehörde FDA möchte zwei Aspekte bei der Zulassung von Medikamenten ändern und stellt ihre Vorschläge öffentlich zur Diskussion: Zum einen sollen Doppelanforderungen abgebaut werden, etwa bei der Zulassung von Fütterungsarzneimitteln die mehrere neue Medikamente enthalten. Bisher muss der Hersteller für jedes einzelne Medikament eine Zulassung beantragen und zusätzlich eine Zulassung für die verwendete Kombination. Dieses doppelte Verfahren wollen FDA und Industrie abschaffen, um die Entwicklungs- und Zulassungskosten für neue Kombinationspräparate zu verringern und das Zulassungsverfahren zu beschleunigen.
Einfache „auflagengebundene“ Zulassungen erleichtern
Zum anderen sollen sogenannte „auflagengebundene Zulassungen“ erleichtert werden. Solche „vereinfachten“ und an spezielle Bedingungen gekoppelte Zulassungen gibt es bisher nur für seltene Tierarten und für seltene Erkrankungen bei häufig vorkommenden Haustieren. In beiden Fällen würde sich ein ordnungsgemäßes und komplexes Zulassungsverfahren wirtschaftlich schlicht nicht lohnen. Das FDA möchte die „auflagengebundene Zulassung“ auch für andere Indikationen und Tiergruppen einführen: Mit dieser begrenzten Zulassung sollen die Pharmaunternehmen dann zunächst weitere Daten sammeln können, um letztlich eine normale Zulassung zu beantragen.
In einer Anhörung, zu der noch bis zum 9. März 2015 bei Stellungnahmen eingereicht werden können, möchte die FDA von der Öffentlichkeit wissen für welche neuen Tiermedikamente eine solche auflagengebundene Zulassung in Frage kommen könnte und warum. Außerdem wird erfragt, ob diese neue Vergabe von auflagengebundenen Zulassungen die Tiergesundheit positiv oder negativ beeinflussen könnte.
Eingesparte Kosten in Neuentwicklungen investieren
Die Behörde betont ausdrücklich, dass die Industrie durch die Änderungen Kosten einsparen würde. Das soll die Entwicklung neuer Medikamente attraktiver machen, ohne die Verbrauchersicherheit zu gefährden. Die FDA hofft – auch mit Blick auf zunehmende Resistenzen gegen Antibiotika –,dass sich die Pharmaindustrie dann wieder stärker der Forschung und Entwicklung neuer Präparate widmet, damit nicht zu Engpässen bei der Versorgung kranker Tiere kommt.
EU: Umwidmungen vermeiden durch Änderung des Zulassungsverfahren
Einen ähnlichen Ansatz verfolgt auch die Europäische Kommission mit geplanten vereinfachten Zulassungsvorschriften. Dadurch soll es dann auch für Tiere mit geringer wirtschaftlicher Bedeutung (Ziegen, Milchschafe, Schlachtpferde) zugelassene Medikamente geben Damit würden bisher übliche Umwidmungen überflüssig. Die Kommission verspricht sich davon mehr Sicherheit bei der Behandlung der entsprechenden Tierarten – und auch mehr Sicherheit für den Verbraucher.
Außerdem will sie die Richtlinie über Fütterungsarzneimittel (90/167/EWG) durch eine neue Verordnung ersetzen, die Produktionsstandards und Vermarktung von Arzneifuttermitteln in der EU vereinheitlicht. Arzneifuttermittel sollen in Zukunft ausschließlich dafür zugelassene Herstellern aus speziell dafür zugelassenen Tierarzneimitteln zusammenstellen dürfen. Gleichzeitig soll explizit verboten werden, Arzneifuttermittel präventiv oder als Wachstumsförderer einzusetzen. Darüber hinaus will die EU die Rückstandshöchstmengen für Tierarzneimittel in gewöhnlichen Futtermitteln neu festlegen. An Stelle einer öffentlichen Befragung wie in den USA, beraten in Europa das Europäische Parlament und der Rat über die Vorschläge der Kommission und werden dann ihre Einschätzungen vorlegen.
Quellen: bovinevetonline – ec.europa.eu



 „Wildtiere brauchen in den aller seltensten Fällen menschliche Hilfe," sagt die Landestierschutzbeauftragte Hessen. Was tun kann, wer ein Wildtier findet – oder aber auch besser lassen sollte – erklärt ein Flyer, den Dr. Madeleine Martin zusammen mit der Landestierärztekammer Hessen herausgegeben hat.
„Wildtiere brauchen in den aller seltensten Fällen menschliche Hilfe," sagt die Landestierschutzbeauftragte Hessen. Was tun kann, wer ein Wildtier findet – oder aber auch besser lassen sollte – erklärt ein Flyer, den Dr. Madeleine Martin zusammen mit der Landestierärztekammer Hessen herausgegeben hat.